هنگامی که سازو کارهای به سلولهای بنیادی کشف شد ، امیدهای بسیاری برای درمان بیماریها از طریق ترمیم بافتهای فرسوده یا آسیب دیده بوسیله سلولهای بنیادی فراهم شد ، در واقع امیدهای زیادی ایجاد شد که بتوان بافتها را دوباره جوان کرد یا از نارسائی نجات داد مثل برگرداندن روند نارسائی قلبی و یا نارسائی کلیه ، نارسائی کبد ، آتروفی مغزی ، دژنریشن غضروف مفاصل ( آرتروز ) ، پیری پوست و غیره ، اما بزودی مشخص شد که اگرچه امیدها و راه درست است ، اما خیلی آسان هم نیست . به عبارتی صرف اینکه یک سلول قدرت تکثیر داشته باشد برای جوان شدن و کارا شدن بافت کافی نیست .
یکی از نکات بسیار جالب اینکه تمامی سلولهای ما در تعامل با محیط خود عمل میکنند ، در واقع یک سلول هرگز یک واحد عمل کننده و یا تغییر دهنده مستقل نیست ، فعالیت سلول به طور دائم تحت تاثیر واسطههای ترشح شده از سایر سلول ها و بخصوص اگزوزوم سایر سلولهای و حتی محیط فیزیکی و داربست داخل بافت نیز هست . یعنی حتی تعامل غشاء سلول با مولکولها و فیزیک ساختاری داربست داخل بافت میتواند عملکرد سلول را تغییر دهد ، به عبارتی تغییر محیط بافت یا پیری سلولهای آن یا فرسودگی داربست آن حتی میتواند باعث تغییر عملکرد سلولهای بنیادی بافت شود .
به همین دلیل استراتژی اولیه که عبارت بود از وارد کردن سلولهای بنیادی به بافت و انتظار نوسازی بافت ، با عدم نتیجه گیری به سمت واقع گرایی بیشتری رفت .
ایجاد تغییر در محیط بافت ، و استفاده از پیام رسانهای سلولی برای تغییر در کل سلولها منجمله سلولهای بنیادی غیر فعال شده بافت و تمرکز بر بررسی روند پیری سلولی و بافتی و تغییرات محیط شیمیایی و داربست بافت و حتی بحث بیومکانیک بافت در مورد مفاصل مورد بررسی قرار گرفت ، نتیجه اینکه امروزه راهبردهای چند وجهی و بخصوص با تکیه بر پیام رسانها مورد ملاحظه قرار گرفته و نتایج اولیه قابل قبول در حال حصول است .
اما خود سلول بنیادی هم میتواند به عنوان تغییر دهنده محیط بافت به کار برود که این یکی از خاصیتهای مهم سلول مزانشیمی بنیادی است .
Mesenchymal Stem Cell
سلولهای بنیادی بالغین عملا در همه بافتها وجود دارند اما یکی از مهمترین این سلولها ، سلول مزانشیمی بنیادی میباشد ، که امکانات بسیاری را در سلول درمانی فراهم آورده است در واقع بخش بزرگی از موفقیتهای سلول درمانی در حال حاضر بر اساس خواص بسیار عالی این سلول به دست آمده است و بسیاری از درمانهایی که مراحل مختلف آزمون بالینی را طی کرده و به عنوان یک درمان استاندارد پذیرفته شده ، درمان با این سلولها می باشد .
به عنوان یک تعریف ساده کوتاه ، سلولهای بدن انسان در دوره جنینی از سه لایه سلولی مشتق میشوند ، اکتودرم ( ایجاد کننده پوست و سیستم عصبی ) مزودرم ( ایجاد کننده خون و سیستم ایمنی و بافت همبندی شامل عضلات ، استخوان ، غضروف ، تاندون و رباط ، بافت زیر پوستی ، بافت چربی و سیستم قلبی عروقی ) ، اندوردرم ( ایجاد کننده لایه داخلی دستگاه گوارش و ادراری و تنفسی و غدد درون ریز ) .
سلول مزانشیمی بنیادی Mesenchymal Stem Cell یاMSC سلول بنیادی بالغین بافتهای مشتق مزانشیمی است ، این سلول بنیادی توانایی ساخت تمام عناصر خونی و بافتهای همبندی را دارد اما در مرحله بعدی تمایز ، به سلول پیشساز ردههای خونی و سلول سازنده بافت همبندی تبدیل میشود که میتواند سلولهای پیش ساز استخوان ، غضروف ، رباط ، تاندون ، بافت همبند پوست و مخاط و سایر ارگانها ، سلول چربی ، و انواع سلولهای عضلانی مخطط عضلات ارادی ، عضله قلبی ، عروق خونی و عضلات صاف جدار لوله گوارش را بسازد .
فعال کردن سلول های بنیادی بافت با استفاده از فاکتور های رشد
این فرض و منطق وجود دارد که به جای اینکه سلول بنیادی وارد یک بافت کنیم ،
با تسلط بر ارتباطات بین سلولی شاید بتوان خود سلول های بنیادی داخل بافت را فعال نمود.
در واقع مهمترین راه تغییر وضعیت یک بافت ، تسلط بر پیام رسان های بین سلولی است.
سلول ها به سه طریق به هم پیام میرسانند :
1- اتصال مستقیم سیتوپلاسمی و جابجایی مواد یا حتی ارگانل هایی مثل میتوکندری
2- مکانیسم رسپتور لیگاند ، شامل ارتباط آندوکرین و آپوکرین و اتصال مستقیم سطحی
3- از طریق اگزوزوم
مکانیسم رسپتور لیگاند :
جفت شدگی سه بعدی یک لیگاند به رسپتور سطح سلول باعث میشود که ادامه داخل سلولی رسپتور دچار تغییر در شکل و شارژ میشود و ابشاری از تغییرات سیتوپلاسمی را سبب میشود که ممکن است تغییرات به داخل هسته نیز گسترش یابد.
انواع مختلف سیستم رسپتور لیگاند
1- در حالت های خاص ممکن است لیگاند جزئی از دیواره یک سلول همسایه باشد .
2- نوع خاصی از این مکانیسم در سیناپس های سلول های عصبی وجود دارد .
3- اگر لیگاند در خون ترشح شود و بر روی سلول های دوردست اثر گذارد به نام هورمون نامیده شده و این روش ارتباطی ، آندوکرین نامیده میشود .
4- اگر لیگاند در بافت پخش شود ، به نام فاکتور رشد نامیده میشود . و این سیستم ارتباطی سیستم آپوکرین نامیده میشود . در مورد سیستم ایمنی ، فاکتور رشد به نام سایتوکین نامیده میشود .
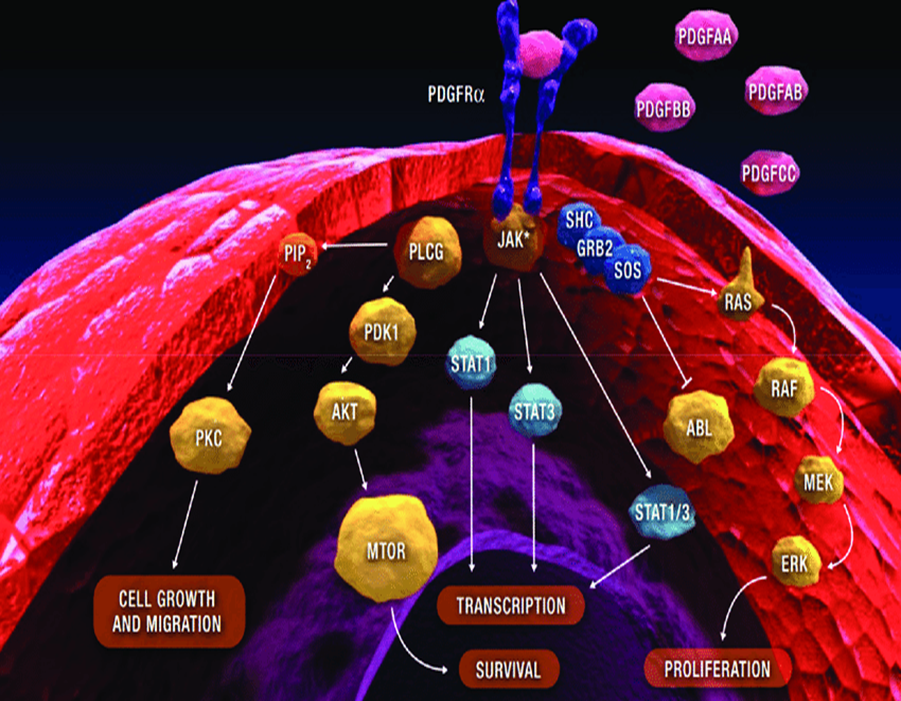
تعداد زیادی فاکتور رشد شناسایی شده وهر یک بر روی تعداد زیادی از گیرنده های تعداد زیادی از سلول ها اثر میکند و یک سیستم وسیع از تعامل ایجاد میشود.
فاکتورهای رشد در سیستم عصبی
فاکتورهای رشد با منشاء پلاکتی
پلاکتها خون در واقع قطعاتی از سلولهایی بزرگ به نام مگاکاریوسیت هستند که از محل رشد این سلولها در مغز استخوان در جریان خون آزاد می شوند و پر از کیسه ( وزیکول )هایی هستند که دو نوع فاکتور دارند یکی فاکتورهای انعقادی و دوم انواع زیادی از فاکتورهای رشد بافت همبندی . در صورت آسیب بافت ، عروق بافت هم پاره می شوند و خونریزی شروع می شود . جدار داخلی عروق از سلولهایی با سطح بسیار صاف تشکیل شده که هیچوقت به پلاکتها یا سایر سلوولهای خونی اسیب نمی رسانند ، در پارگی عروق این لایه داخلی هم پاره شده و و پلاکت ها با برخورد به لایههای عمقیتر پاره شده و مواد خود را ازاد میکنند ، فاکتورهای انعقادی موجب انعقاد خون میشوند و فاکتورهای رشد باعث تحریک سلولهای بنیادی بافت برای فعال شدن و مهاجرت به ناحیه آسیب و تولید سلول برای بازسازی بافت می شوند .
با توجه به فراوانی پلاکتها در خون محیطی و سهولت خونگیری و جدا سازی پلاکتها از خون ، عملا بهترین منبع فاکتورهای رشد بافت همبندی میباشند .
در سادهترین روش که PRP نامیده میشود ، حدود ده سی سی خون از بیمار گرفته شده و سانتریفیوژ میشود ، گلبول های قرمز ته نشین میشوند بر روی آنها یک لایه نازک شامل گلبول های سفید قرار میگیرد و بر روی آن سرم خون که اکثر پلاکتهای خون در یک سوم تحتانی آن قرار میگیرند ، این بخش را میتوان با سرنگ کشید و پس از اضافه کردن فعال کنندهای که باعث پارگی پلاکتها و آزاد شدن فاکتورهای داخل آنها می شود ، میتوان آنها را به بافت تزریق نمود .
نتایج انجام PRP (Platelet Rich Plasma) در مورد اسیبهای بافت همبندی و مشکلات پوستی در موارد بخوبی انتخاب شده خوب و قابل قبول بود اگرچه نتایج معجزهآسایی نیز وجود نداشت ، اما سهولت انجام و عدم وجود عوارض و استفاده از مواد بیولوژیک بدست آمده از خود فرد ، انجام آنرا منطقی میکند .
متعاقبا تحقیقات بسیاری انجام شد و معلوم شد تعداد کمی گلبول سفید که وارد میشوند نتایج را ضعیف میکنند. از طرفی همه آنچه فاکتور رشد نامیده میشود و در کیسههای پلاکتی وجود دارد الزاما موجب آثار مثبت در بافت همبندی نمیشود و البته در مورد فاکتورهای رشد مفید نیز میزان متعادلی از آن عملکرد مثبت دارد. در ضمن با استفاده از پلاکتها عملا فاکتورهای انعقادی نیز وارد میشوند که عملکرد آنها در مورد ترمیم بافت کاملا مشخص نیست.
پس روشی به نام PRGF (Plasma Rich of Growth Factors) ابداع شد. در روش پس از جدا کردن پلاسما در یک روش انکوباسیون مدت دار به تدریج محلول روبه ایجاد انعقاد رفته و گلبولهای سفید و تمام فاکتورهای انعقادی و لاشههای پلاکتی در یک لخته از سرم جدا میشود، ضمن اینکه با آزادسازی تدریجی ، فاکتورهای رشد مناسب و در غلظت مناسب بدست میآید.
وارد کردن سلولهای بنیادی مزانشیمی به بافت یا داخل وریدی
در این روش سلول وارد شده با واکنش به محیط ، عملکردی را در رابطه با اصلاح وضعیت بیماری زا انجام میدهد .
یکی از پیشرفت های بسیار بزرگ کاربردی ، شناسایی عملکردی مهم از سلولهای بنیادی مزانشیمی در جفت و بند ناف بود که خاصیت تنظیم کننده سیستم ایمنی Immunomodulatory این سلولها است که میتوانند التهاب حاد یا مزمن و همچنین سیستم ایمنی بیش از حد فعال شده در بعضی عفونت ها و بیماریهای خودایمنی را مهار کنند.
خاصیت مهم دیگر این سلول ها ایمونوژنسیته بسیار پایین آن ها است به عبارتی بخشی از مجموعه سازگاری بافتی را که باعث شناسایی به عنوان سلول بیگانه میشود ، را در سطح خود بروز نمیدهند ، یعنی به راحتی و بی دغدغه میتوان آن ها را از جفت ، بند ناف جنین های متولد شده گرفت ، تکثیر نمود و به صورت آلوگرافت به دیگر افراد تزریق نمود.
تنظیم سیستم ایمنی حاصل از تزریق این سلول ها در موارد زیر قابل استفاده است :
1- در موارد بیماری های خودایمنی
2- در بسیاری از موارد آسیب مزمن که زمینه التهابی در بافت جلوی ترمیم را گرفته است بخصوص در مشکلات مفصلی
3- در آسیبهای حاد و بخصوص آسیب های حاد ایسکمیک ( ناشی از کمبود خونرسانی ) مثل سکته قلبی و مغزی موثر نشان داده شده است
4- آسیب حاد تروماتیک مثل آسیب نخاع
5- در مورد GVHD
6- در طوفان سایتوکین موارد شدید بیماری کووید 19
سلول های بنیادی مزانشیمی اتولوگ
اتولوگبه معنی تزریق سلول یا سایر قراوردهها از خود فرد می باشد .
شناخته شده ترین منشاء این سلول ها از مغز استخوان است ، اما فرایند سخت تهیه ، باعث شده امروزه کمتر مورد استفاده باشد .
منبع مهمی که امروزه خیلی مورد استفاده است ، بافت چربی است که منبعی بسیار عالی برای سلول های بنیادی مزانشیمی است بخصوص اگر منظور اعمال زیبایی و در کنار آن باشد .
روش جالب دیگر به دست آوردن آن ها از خون محیطی است که البته به طور معمول تعداد آنها در خون محیطی زیاد نیست اما با تزریق GCSF (granulocyte colony-stimulating factor) از چهار تا پنج روز قبل ، میتوان تعداد آنها در جریان خون محیطی را افزایش داد .
سلول های اتولوگ به جز اینکه خاصیت خود سلول یعنی تنظیم سیستم ایمنی و ایجاد تغییر در محیط بافت و القاء خاصیت ترمیمی و فعال سازی سلول های بنیادی خود بافت را دارد ،
به صورت تئوریک این مزیت را دارد که بتواند در بافت engraft شده و شاید تبدیل به سلول های بافت شود که البته در حد قابل توجهی نیست و به نظر می رسد تاثیر بر خود سلول های بافت و بخصوص سلول های بنیادی بافت ، عامل بیشتر آثار مثبت تزریق این سلول ها باشد .
سلول های بنیادی مزانشیمی آلوگرافت
همولوگ یعنی سلول از فرد دیگری گرفته شود که منظور اصلی در این مورد گرفتن بنیادی مزانشیمی از جفت است .
اینکه سلول های بنیادی مزانشیمی به دست آمده از جفت را بدون مشکل میتوان به صورت آلوگرافت به کار برد ، شانس بسیار بزرگی در حیطه سلول درمانی است .
در واقع لایه ای از جفت که در جوار بدن مادر است ، مسئول محافظت جنین در برابر سیستم ایمنی مادر است که با نیمی از جنین عملا ناسازگار است ، وعلت آن را عدم بروز کمپلکس سازگاری بافتی MHC-I در سطح این سلول ها میدانند .
به این ترتیب ، استفاده از سلول های مزانشیمی جفت و بند ناف آلوگرافت برای تزریق بسیار معمول شد ، بخصوص که خواص ضدالتهابی بسیار عالی داشته و مسئله گرفتن سلول از خود فرد و نیاز به صرف زمان برای تکثیر منتفی است ، با گرفتن سلول ها از جفت و بندناف و تکثیر آن ها همیشه منبع آماده خالص از سلول پر کیفیت آماده استفاده است تا در هر قسمت بدن با تزریق داخل بافت از خاصیت ضدالتهابی و آزادسازی فاکتور رشد استفاده کنیم و همچنین با تزریق داخل وریدی بتوانیم از خاصیت تنظیم کننده سیستم ایمنی و ضدالتهابی بهرهمند شویم .
برخی محققان امکان تمایز این سلول های الوگرافت به سلول بافت مورد نظر را هم در تزریق داخل بافت مدنظر گرفته اند اما به نظر میرسد در صورت تمایز ، مثلا به سلول قلبی ماهیت سلول عوض شده و با بروز کمپلکس سازگاری بافتی به عنوان بیگانه شناسایی و تخریب شوند .
استفاده از اگزوزوم به عنوان پیام رسان و ایجاد تاثیرات سلول
Free Cell Therapy
همانطور که ملاحظه شد ، ممکن است ما بخواهیم سلولی را وارد بدن کنیم ، نه منظور تکثیر و تمایز و انگرافت شدن و ایجاد عملکرد بافت ، بلکه به دلیل اینکه سلول وارد شده ، بر سایر سلول های عادی و یا بنیادی بافت و یا سلول های سیستم ایمنی تاثیر بگذارد ،
در این حالت ما میتوانیم به جای سلول ، فرآورده سلول را که پیغام رسان سلول به سلول های دیگر است را استفاده کنیم .
اگزوزوم وسیله نقلیه ای است که میتواند تنوع وسیعی از مولکول های حیاتی از پروتئین ها و بخصوص فاکتور رشد گرفته تا اسید نوکلئیک را مستقیما وارد سلول هدف نماید ،
این روش پیام رسانی ، روشی بسیار اختصاصی است و بسیار موثرتر از روش رسپتور لیگاند است که قبلا توضیح داده شد عمل میکند .
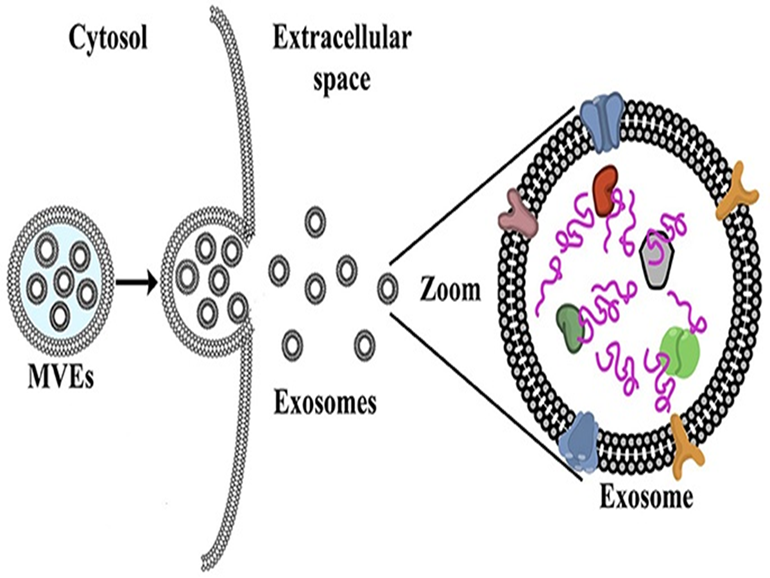
اگزوزوم اولین بار در سال 1980 کشف شد ، تمام سلول های بدن از سلول های رویان و جنین تا سلول های بنیادی و عادی سالم و یا بیمار و حتی سلول های سرطانی اگزوزوم ترشح میکنند تا بر دیگر سلول ها تاثیر بگذارند ، در ابتدا تصور میشد اگزوزوم ها مثل قطعات بزرگتری که آپوپتوتیک بادی نام دارند و شامل قطعات فرسوده و دفعی سلول است و برای دفع مواد بی مصرف ، ایجاد میشوند و حتی قطعات کوچک اسید نوکلئیک داخل آن ها نیز به نظر خرده های بی مصرف میرسید ، و تا حد زیادی نام گذاری اگزوزوم هم از این دیدگاه و به معنی کره های دفعی است . ( با دیدگاه امروزی بهترین نام سیگنالوزوم به معنی کره های پیام رسان است )
اما مشخص شد که تولید اگزوزوم یک فرآیند کاملا برنامه ریزی شده است و حتی ژن های خاصی در مخزن ژنتیکی هر سلول مسئول ایجاد رشته هایی از RNA است که با عملکرد آنزیم های خاصی ، تبدیل به میکروآرآن ای mirRNA شده و در سیستم رتیناکولوم آندوپلاسمیک وارد اگزوزوم ها میشوند .
( 3 درصد ژنهای کد کننده ، به جای پروتئین انواع mirRNA را کد میکنند )
یکی از اولین دستاوردهای این کشفیات این بود که اگر تکثیر و تمایز سلول بنیادی در یک بافت مد نظر نیست و می خواهیم از آثار و خواص یک سلول بنیادی استفاده کنیم :
به جای خود سلول میتوان از اگزوزوم آن استفاده کرد ، مثلا اگر میخواهیم از سلول بنیادی مزانشیمی برای کاهش التهاب و یا تحریک ترمیم توسط سایر سلول های بنیادی استفاده کنیم ، میتوانیم صرفا از اگزوزوم آن استفاده کنیم و به این ترتیب راهبرد free cell therapy ایجاد شد .
استفاده از اگزوزوم به جای سلول مزایای بسیار زیادی دارد :
1- اولا حمل و نقل و ذخیره سازی طولانی اگزوزوم بسیار آسان و همانند دارو می باشد. در حالیکه جابجایی سلول زنده ، مشکل و قاعدتا باید در مجاورت محل کشت ، استفاده شود.
2- اگرچه سلول بنیادی مزانشیمی به دلیل بروز ندادن کمپلکس سازگاری بافتی در سطح خود عملا به راحتی قابل تزریق آلوژنیک است ، اما بازهم دغدغه وارد کردن سلول زنده وجود دارد .در حالیکه در تزریق اگزوزم بدون وارد کردن سلول زنده ، با رساندن پیام رسان آن همام نتایج به دست میآید .
3- برداشتن سلول از خود فرد هم هم زحمت تهیه سلول و هم انتظار کشت را دارد .
4- در ضمن تزریق سلول با پروتکل های فعلی در فواصل زمانی کوتاه امکان پذیر نیست ، در حالیکه اگزوزوم به راحتی و کاملا شبیه به دارو قابل استفاده مکرر است و تجربیات اخیر کاملا به بی عارضه بودن آن تاکید دارد .
هر سلول اگزوزوم اختصاصی خود را دارد ، به پیدا کردن خواص اگزوزوم هر سلول عملا گستره جدیدی از امکانات را در اختیارمان میگذارد .
امروزه اگزوزوم های مرانشیمال استم سل وارد حیطه درمانی شده است
و اگزوزوم پلاکتی ، اگزوزوم سلول های ایمنی و اگزوزوم های سلول های سرطانی مورد استفاده تحقیقاتی هستند .
یکی از نکات جالب دیگر اینکه میتوان ، اگزوزوم ها را سفارشی نمود ، در واقع با تغییرات در محیط کشت سلول میتوان محتوای اگزوزوم را سفارشی نمود به صورت فعال و غیرفعال ، در حالت فعال خود سلول بر اساس برنامه ریزی ژنتیک خود به تغییر محیط پاسخ میدهد ، برای مثال اگر محیط کشت MSC را کمی دچار کمبود اکسیژن کنیم اگزوزومهایی تولید میشود که باعث آنژیوژنز ( افزایش مویرگها) بافت میشود ، به عبارتی سلول با تاثیر از طریق اگزوزوم بر سلول های آندوتلیال جدار مویرگ ها و افزایش مویرگ ها استارت افزایش خونرسانی و اکسیژن بافت را ایجاد میکند . اگر واسطههای التهابی را به محیط کشت سلول MSC اضافه کنیم ، اگزوزوم هایی ایجاد میشئد که خاصیت ضد التهابی بیشتری و در بعضی موارد دقیقا کاهش دهنده همان فاکتور التهابی را دارند . از طرفی ممکن است به صورت غیرفعال اگزوزوم را سفارشی نمود ، یعنی صرفا غلظت مادهای در محیط کشت بالا برد ( البته تا جایی که سلول آسیب نبیند ) و همانطور که در همه جای سلول غلظت آن ماده افزایش میآید ، در اگزوزوم نیز غلظت آن افزایش میابد .
همچنین میتوان اگزوزومها را مهندسی نمود
میتوان با امواج اولتراسوند و یا شوک الکتریکی برای مدت کوتاهی جدار آن ها را باز نمود و باعث ورود مولکول های دارو از محیط به داخل اگزوزوم شد و یا با چسباندن مولکول های خاص به جدار آن باعث هدف گیری سلول های خاصی شد و بتوان داروی خاصی را به داخل سلول خاصی رساند .
امکاناتی که دانش استفاده از اگزوزوم در اختیار میگذارد بقدری زیاد است که قطعا در آینده نقش مهمی در درمان و حتی تشخیص به عنوان بیومارکر خواهد داشت .
جالب اینکه برای مصارف در مقیاس بالا حتی میتوان از شیر اگزوزوم جدا کرد .
Regenerative medicine Advanced Therapy
در آمریکا به توجه به گسترش روزافزون درمانهای مدرن ، برای استاندارسازی و نظارت بر اقدامات بر مهندسی بافت و سلول درمانی شامل
مهندسی بافت
تزریق سلول بنیادی
استفاده از فرآورده سلولی
دستکاری سلول ها شامل کشت و تغییرات محیط کشت (مینور ) یا دستکاری ژنتیک ( ماژور) و سپس برگرداندن به بدن
اقدامات ترکیبی از موارد فوق
FDA اقدام به ایجاد ساختار جدیدی به نام RMAT را برای اعطاء مجوز تحقیقاتی و درمانی نموده است
RMAT (Regenerative Medicine Advanced Therapy)